Nitraat
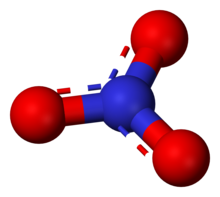

Nitraat is in sâlt mei de algemiene namme fan in poly-atomysk anion (NO3-) of funksjonele groep (R-O-NO2) dy't ien stikstof-atoom en trije soerstof-atomen befettet. Yn nitraten hat stikstof in oksidaasjetastân fan +5. Gemysk sjoen is salpetersoer (HNO3) de stamferbining fan de nitraatgroep.
Nitraat-ioanen foarmje mei metalen altyd ioanogene ferbinings, benammen mei (ierd-)-alkalimetalen. De ferbinings sulvernitraat en lead(II)nitraat wurde in soad brûkt yn laboratoariums. Mei alle metaal-ioanen, en it ammoanium-ion, foarmet it nitraat-ion nijsgjirrich genôch altyd in yn wetter te oplossen sâlt. Salpetersoer is in krêftige oksidator. Nitraatesters binne faak tige goed te baarnen en te ûntploffen.
Nitraten wurde yn de triviale nammejouwing gauris as it efterheaksel salpeter neamd:
- Kaliumnitraat: kalisalpeter of salpeter
- Kalsiumnitraat: kalksalpeter
- Ammoaniumnitraat: ammoaniumsalpeter
- Natriumnitraat: silisalpeter
Struktuer
[bewurkje seksje | boarne bewurkje]It anion is it konjugearre tsjinsoer fan salpetersoer, dat út ien stikstof-atoom yn it midden omjûn troch trije likense ferbûne soerstof-atomen yn in trigonaal planêr systeem bestiet. It nitraat-ion hat de lading fan -1. Dat waard feroarsake troch de formele lading dêr't elts fan de trije soerstof-atomen in lading hawwe fan −⅔ en it stikstof-atoom in lading fan +1 hat, dy't de formele lading fan it nitraat-ion foarmje. Dy regeling wurdt gauris brûkt as in foarbyld fan resonânsje. Lykas it iso-elektroanysk karbonaat-ion, hat it nitraat-ion de folgjende resonânsje-struktueren:
Gebrûk
[bewurkje seksje | boarne bewurkje]Keunstdong
[bewurkje seksje | boarne bewurkje]Nitraatsâlten wurde ek brûkt as keunstdong, om't se maklik op te lossen binne en om't se stikstof befetsje. Almeast giet it dêr om ammoanium- en natriumnitraat. Kalkammonsalpeter (KAS) bestiet út sa'n 70% ammoaniumnitraat (NH4NO3), 25% kalsiumnitraat (CaCO3) en de rêst út magnesiumokside (MgO). Ek besteane der mingdongstoffen (NPK), dêr't útsein ammoanium (N) ek oare dongstoffen taheake binne lykas fosfaat (P) en kaly (K). Ek silisalpeter (NaNO3) wurdt brûkt. Silisalpeter komt út de Sileenske woastyn wei. Nitraat wurdt ek gauris brûkt yn de foarm fan ammoanium, ureum of sels mei de ynjeksje fan ammoniak. Dat hat as foardiel dat de nitraat stadiger frij komt, om't ammonium earst troch nitrifisearjende baktearjes omsetten wurde moat ta nitraat. Ek hat ammoanium foar bepaalde gewaaksen it foardiel dat de pH leger is.
Nettsjinsteande de soad foarmen fan stikstofhâldende dongstoffen, fan nitraat ta ureum en fan organysk ta anorganysk, jilde foar alle stikstofboarnen it selde hoemannichte kg suvere stikstof. 100 kg nitraat (NO3) wurdt dan ek oanjûn as 23 kg suvere stikstof.
Nitraat is part fan de stikstofrûntegong. De boarne fan nitraat en oare stikstofhâldende dongstoffen wurdt foarme troch loftstikstof (N2), dêrfan't de loft 78% út bestiet. Nitraat kin ek op natuerlike wize ûntstean, lykas stikstofbining troch woartelknollen yn flinterblommigen en as NOx as gefolch fan in lykwichtsreaksje tusken soerstof en loftstikstof bij wjerljocht. Ek fynt dy lykwichtsreaksje plak by natuerlike ferbaarningsprosesssen sa as bygelyks tsjettels en ferbaarningsmotors. Nitraatferlies fynt plak troch it opnimmen troch planten, útspieling troch in rynske reinfal en troch denitrifikaasje as, as gefolch fan in minne struktuer fan de boaiem, bepaalde baktearjes de soerstof-atomen yn it nitraat brûke. By denitrifikaasje ferdwynt de nitraat dan ek as loftstikstof tebek yn de atmosfear, dat de stikstofrûntegong wer rûn makket.
Oare gebrûken
[bewurkje seksje | boarne bewurkje]Nitraten wurde ek yn laboratoariums brûkt om't it sâlt maklik op te lossen is. Ek foar fjoerwurk en oare eksplosiven wurdt it brûkt.
Sjoch ek
[bewurkje seksje | boarne bewurkje]| Boarnen, noaten en/as referinsjes: |
|
Foar boarnen en oare literatuer, sjoch ûnder: References, op dizze side. |

