Atoom
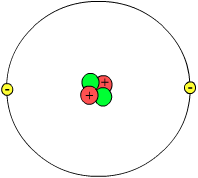
In atoom is it lytste skaaimerkende boustientsje fan in skiekundich elemint. Elk elemint hat syn eigen soarte atoom. Neffens de klassike atoomteory fan Dalton (om 1800 hinne) binne atomen ûndielbere hurde boltsjes, elk mei har eigen massa. Dy gedachte waard befestige troch eksperiminten. As je stoffen ferhitte of der op in oare wize energy oan tafoegje (ljocht of elektryske stroom) feroarje se yn oare stoffen. Dat komt, omdat de boustientsjes fan dy stoffen (molekulen) stikkenmakke wurde yn lytsere brokjes. Guon stoffen kinne net op dy wize feroare wurde, dat binne de eleminten.
Yn de moderne atoomteory (begûn om 1900 hinne) is it idee dat atomen hurde ûndielbere boltsjes binne loslitten en wurdt ferûndersteld dat atomen foar it grutste part hol binne en opboud út lytsere elemintêre dieltsjes, protoanen, neutroanen en elektroanen . De earste twa foarmje in lytse hurde 'pit' yn it atoom, de atoomkearn. De lêste draaie op sekere ôfstân om dy kearn hinne. Elektroanen hawwe yn fergeliking mei protoanen en neutroanen in folle lytsere massa. Sa goed as alle massa fan in atoom sit dus yn de kearn gearpakt.
It krusiale eksperimint dat late ta it nije konsept fan in hol atoom mei in kearn waard útfierd troch Ernest Rutherford yn 1911. Lettere eksperiminten toanden oan dat ek protoanen en neutroanen op har bar wer opboud binne út noch lytsere dieltsjes.
Atoombou
[bewurkje seksje | boarne bewurkje]In proton hat in lading fan +1, in elektron fan -1. It neutron hat gjin lading. De ienheid fan dizze lading is de elemintêre ladingsienheid. De ferskillen tusken atomen wurde benammen útmakke troch it oantal protoanen yn de kearn. Sa hat in izeratoom 26 protoanen yn de kearn, in goudatoom 79. Tagelyk sirkelje by izer 26 elektroanen om de kearn hinne, by goud 79. Omdat protoanen en elektroanen deselde lading ha, mar tsjinsteld, heffe dy ladingen elkoar op. 'Fan bûten ôf sjoen' hat in atoom gjin lading. It oantal protoanen fan in atoom is it atoomnûmer.
Ioanen
[bewurkje seksje | boarne bewurkje]Atomen kinne elektroanen kwytreitsje, of ekstra elektroanen derby krije. Dan is it lykwicht fan lading ferbrutsen en hat it atoom in netto lading krigen. It dieltsje dat dan ûntstiet hjit in ion. Nammers, ek molekulen (in groepke atomen oan elkoar fêst) kin syn ladingslykwicht ferlieze, en ek dan is der sprake fan in ion.
Elektroanewolk
[bewurkje seksje | boarne bewurkje]
De elektroanen sitte net op ien en itselde plak, mar bewege sa fluch om de kearn hinne, dat se by wize fan sprekken oeral tagelyk binne. Se foarmje in wolk fan negative lading om de kearn. Wat fierder fan de kearn, wat tinner de wolk. As twa atomen te ticht by elkoar komme, fernimme se elkoars positive lading dy't op ien punt gearballe sit yn de kearn, en stjitte se elkoar ôf. Dêrom dat atomen net samar in ein yn elkoar skood wurde kinne, ek al binne se hol. Atomen 'nimme elkoars oanwêzichheid waar' as tichte, ûntrochkringbere boltsjes, en dêrmei komt it atoommodel fan Dalton wer werom as in ienfâldiger mar net ûnkrekt model fan de wrâld op atomêr nivo.
As twa atomen A en B mei elkoar reagearje en in bining mei elkoar foarmje, dan komt dat omdat de positive lading yn de kearn fan A de negatyf laden elektroanenwolk fan it oare atoom B oanlûkt, en omgekeard. Dat hjit in atoombining. De bining hat daliks te krijen mei de elektroanewolken fan de atomen. It is de elektroanewolk dy't by gemyske reaksjes feroarje kin, de atoomkearn feroaret net (by ferskynsels as radioaktiviteit en kearnreaksjes lykwols is der wol wat mei de atoomkearn te rêden).
De eigenskippen fan de elektroanewolk bepale oft in atoom biningen foarmje kin, en hokker. Twa H-atomen foarmje neffens boppebeskreaun prinsipe in bining mei elkoar, en sa foarmje se in molekule H2. Mar twa atomen He wolle gjin bining mei elkoar foarmje. It ferskil tusken H en He sit him yn de elektroanewolken fan elk fan dy twa.
Isotopen
[bewurkje seksje | boarne bewurkje]Meastal sitte yn in kearn likefolle of sels mear neutroanen as protoanen. It oantal protoanen en neutroanen by elkoar is it massagetal fan in atoom. Twa atomen dy't wol itselde atoomnûmer ha mar net itselde massagetal hjitte isotopen. Isotopen binne atomen fan itselde elemint dy't allinne fan elkoar ferskille omdat se net deselde massa ha. In bekend foarbyld is it metaal uranium mei atoomnûmer 92. Yn de natoer wurde twa ferskillende isotopen fûn, mei massagetallen 235 en 238, oanjûn as U-235 en U-238. By beide isotopen sitte yn de kearn 92 protoanen, en om de kearn sit in grutte wolk mei 92 elektroanen. De beide soarten uranium gedrage har yn gemysk opsicht dus itselde. Mar it iene atoom is swierder as it oare.
Belang fan it atoombegryp
[bewurkje seksje | boarne bewurkje]In protte skiekundige en natuerkundige eigenskippen fan de matearje dy't op de ierde foarkomt binne sa keppele oan de eigenskippen fan atomen. Dêrom is it atoombegryp in wichtich begryp yn beide wittenskippen.
Skiednis fan it atoombegryp
[bewurkje seksje | boarne bewurkje]Al by de âlde Griken wiene guon filosofen dy't mienden dat de wrâld opboud wie út lytse, ûndielbere dieltsjes; it wurd 'atoom' komt fan it Gryksk ἄτομος, 'atomos' = 'ûndielber'. De wichtichste fan har wie Demokritos.
Sjoch ek
[bewurkje seksje | boarne bewurkje]Keppeling om utens
[bewurkje seksje | boarne bewurkje]- Wikiwurdboek-side - atoom
